近日,基础医学院余潇团队在Advanced Science上,发表了题为“The Toxoplasma Effector GRA4 Hijacks Host TBK1 to Oppositely Regulate Anti-T. gondii Immunity and Tumor Immunotherapy”的研究论文。

弓形虫作为人畜共患寄生虫,可感染几乎所有温血动物,并在免疫功能缺陷的宿主中造成极大危害。据世界卫生组织(WHO)数据统计,全球人群的弓形虫感染率大约在25%~50%。目前急性弓形虫病的一线治疗仍然是抗叶酸达拉普林(乙胺嘧啶)和抗生素磺胺嘧啶的组合,但该方案对缓殖子的治疗低效,且长期治疗会造成耐药,并带来超敏反应、造血缺陷等不良影响,开发新型弓形虫免疫治疗策略已迫在眉睫。因此,探索抗弓形虫免疫应答的调节机制不仅可以丰富人们对抗弓形虫固有免疫应答的认识,同时也能够为新一代安全有效弓形虫疫苗及药物的研发提供理论方向和潜在靶点。
团队前期研究发现,弓形虫感染后产生的I型干扰素(IFN-I)能够抑制T细胞功能进而负调控宿主抗弓形虫免疫应答(mBio,2022),因此寻找弓形虫来源的IFN-I调控分子将帮助我们通过扰动IFN-I通路促进宿主抗弓形虫固有免疫反应。团队通过对多种弓形虫分泌蛋白进行筛选,发现弓形虫致密颗粒蛋白GRA4能够通过TRIM27-p62促进宿主TBK1分子的选择性自噬降解,进而抑制弓形虫感染过程中IFN-I通路活化,而敲除GRA4的缺陷型虫株显著增强弓形虫感染过程中IFN-I的释放,加重宿主弓形虫病的发展。
弓形虫感染过程中可以激活宿主多条固有免疫信号通路,这也赋予其应用于肿瘤免疫治疗的潜能。IFN-I作为肿瘤免疫治疗中的关键细胞因子,团队利用GRA4缺陷弓形虫株能够诱导更强IFN-I反应的特性进一步在减毒型弓形虫株的基础上敲除GRA4,构建了ME49Δompdc/gra4弓形虫减毒活疫苗(已申请专利)。小鼠荷瘤实验表明该疫苗不仅具有良好的生物安全性,还能促进肿瘤及脾脏中的IFN-I表达,并以IFN-I依赖的方式诱导一群特异的树突状细胞发挥高效抗肿瘤效应。综上,该研究发现了来自弓形虫的致密颗粒蛋白作为宿主IFN-I刹车分子,为IFN-I相关疾病及肿瘤免疫治疗提供了新策略。
余潇教授与中山大学伦照荣教授为本文共同通讯作者,基础医学院免疫学教研室博士生胡志强、硕士生张毓芬为本文的并列第一作者。
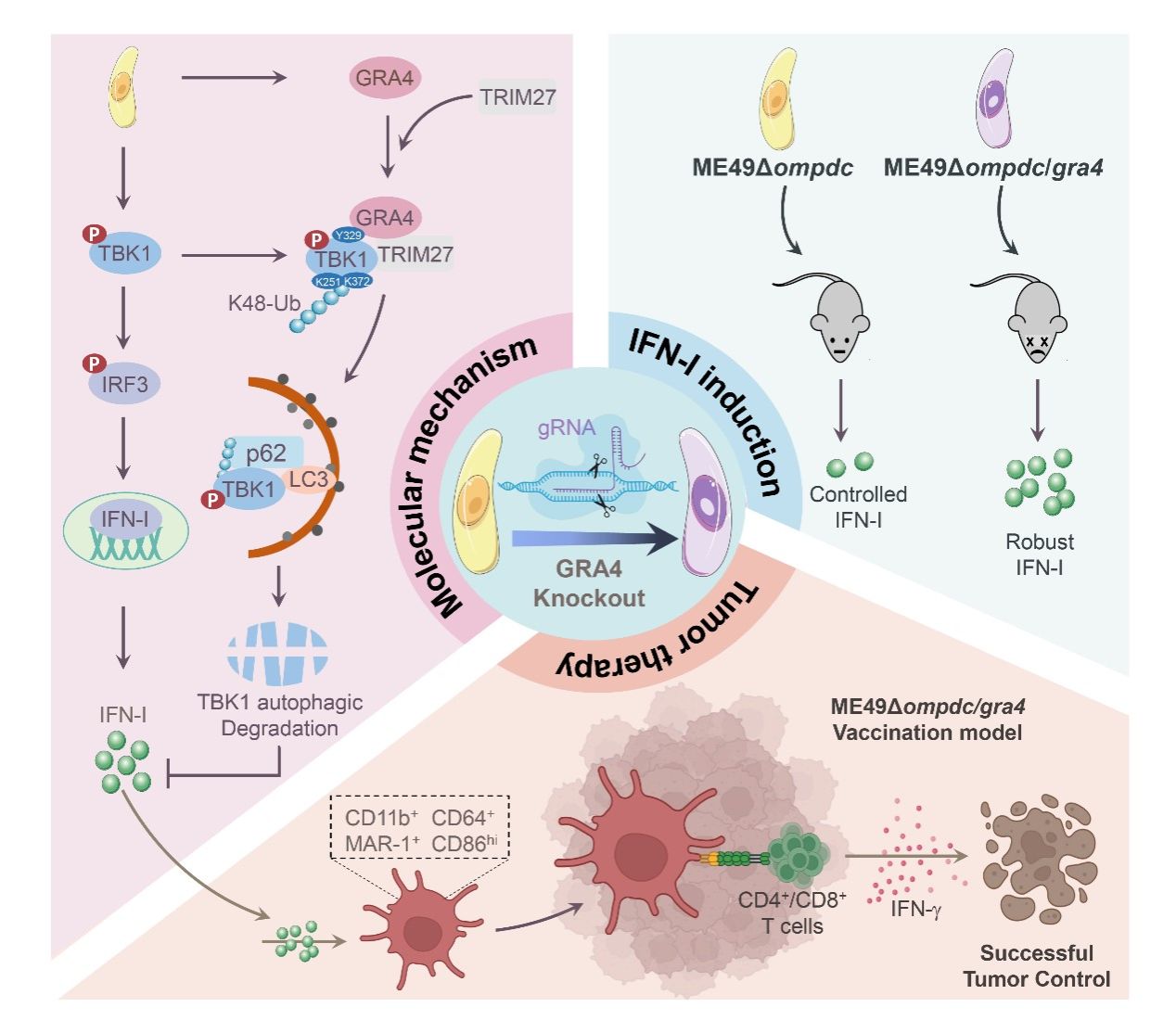
全文机制模式图:GRA4抑制IFN-I通路活化的分子机制及其在弓形虫病和抗肿瘤中的调控功能










