近日,第三附属医院白晓春团队鉴定了瘦素受体的新配体并揭示其促进异位骨化形成的机制。该研究发现,棕色脂肪分泌的血管生成素样蛋白4 (angiopoietin-like protein 4, ANGPTL4) 可通过识别并结合瘦素受体 (leptin receptor, LepR) 参与获得性异位骨化的形成。

该研究重要发现主要包括三个方面:瘦素突变的ob/ob鼠跟腱切断术后可形成异位骨化,而LepR突变的db/db鼠无法形成异位骨化;ANGPTL4是LepR的新配体,参与调控获得性异位骨化形成过程中的间充质干细胞成软骨分化;敲除PRRX1+间充质干细胞的LepR、敲除ANGPTL4或清除LepR+细胞均阻碍了软骨形成与HO发展。
获得性异位骨化(acquired heterotopic ossification, HO)是发生在软组织中的异常但紧密协调的异位骨形成与再生过程。获得性HO常由创伤、手术,烧伤或中枢神经系统损伤等因素引起,造成疼痛和行动障碍。由于其病理发生机制未阐明,目前尚无特异性强的有效治疗药物。HO是一个软骨内成骨的过程,包括炎症、软骨形成,软骨细胞肥大和异位矿化,最后形成具有骨髓的成熟骨。细胞谱系示踪小鼠的证据表明,HO主要来自间充质起源的基质细胞,可以使用Prrx1-Cre进行标记。然而,损伤如何刺激间充质细胞的软骨分化尚不清楚。因此,深入阐述获得性HO的发生及发展机制,探索新的治疗靶点,具有重要的科学意义与临床价值。
Ob/ob和db/db小鼠是目前研究最多的两种糖尿病小鼠模型。自从小鼠瘦素蛋白Leptin(由肥胖(ob)基因编码)和瘦素受体LepR(由糖尿病(db)基因编码)发现以来,许多研究描述了Leptin-LepR在调节能量稳态、葡萄糖摄取和食欲的中心方面的关键作用。Ob/ob和db/db小鼠具有许多共同表型,几十年来,小鼠Leptin被认为是LepR的唯一配体。然而,它们的表型也存在一定的差异,其原因不明确。该研究团队发现,db/db而非ob/ob小鼠出现肌腱断裂术后HO形成障碍,提示LepR存在新的配体。通过筛选发现,在肌腱断裂术后,ANGPTL4 (angiopoietin-like protein 4),一种应激和饥饿诱导的分泌蛋白,由棕色脂肪组织(brown adipose tissue, BAT)合成并分泌至血液,通过在HO部位与PRRX1+间充质干细胞上的LepR直接结合促进软骨形成过程(图)。敲除PRRX1+间充质干细胞的LepR、敲除ANGPTL4或清除LepR+细胞均阻碍了软骨形成与HO发展。该研究鉴定了ANGPTL4是LepR的新配体,在间充质干细胞中通过结合LepR促进异位骨形成,同时提示LepR+细胞可能通过结合瘦素以外的替代配体来调节生理和病理条件下的骨代谢,以及软骨与骨形成,靶向ANGPTL4-LepR可能治疗获得性HO。
研究成果以“ANGPTL4结合瘦素受体调控异位骨化形成(ANGPTL4 binds to leptin receptor to regulate ectopic bone formation)”为题,于2023年12月26日在线发表于《PNAS》杂志。白晓春教授、刘安玲副教授和郭斌博士为论文共同通讯作者,澳门太阳集团www第三附属医院博士后胡红玲、基础医学院硕士研究生罗盛、第三附属医院助理研究员赖萍琳和第五附属医院博士后赖明强为并列第一作者。
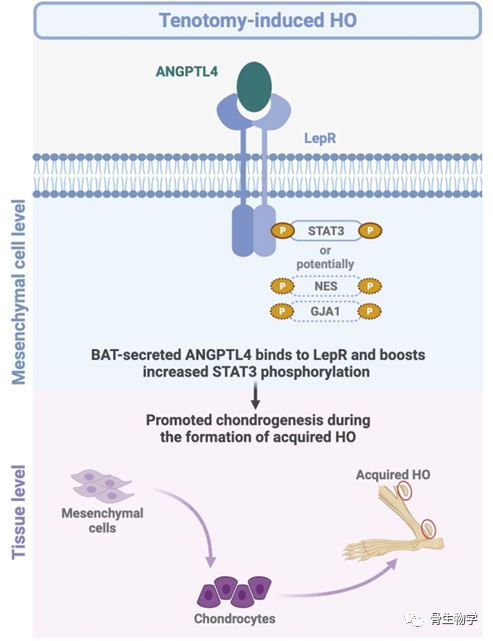
图:BAT分泌的ANGPTL4通过识别并结合LepR参与获得性异位骨化形成的机制模式图。
本研究揭示了肌腱断裂术后,由BAT合成并分泌的ANGPTL4在HO部位结合PRRX1+间充质干细胞上的LepR,从而促进软骨形成的过程。研究结果为靶向治疗获得性HO疾病提供了新思路。










